抽象的
简介:衰老的特点是生理能力的逐渐丧失。在细胞水平上,衰老过程的两个关键标志包括端粒长度 (TL) 缩短和细胞衰老。使用某些高压氧疗法 (HBOT) 协议重复间歇性高氧暴露可以诱导再生效应,这通常发生在缺氧期间。本研究的目的是评估 HBOT 是否影响正常、非病理性、老龄化成年人群中的 TL 和衰老细胞浓度。
方法:招募了 35 名 64 岁及以上的健康独立生活成年人,每天接受 60 次 HBOT 暴露。在基线、第 30次和第60次会话以及最后一次 HBOT 会话后 1-2 周收集全血样本。评估了外周血单个核细胞 (PBMC) 端粒长度和衰老。
结果: HBOT 后,T 辅助细胞、T 细胞毒性细胞、自然杀伤细胞和 B 细胞的端粒长度显着增加了 20% 以上。最显着的变化出现在 B 细胞中,在第 30次、第60次和 HBOT 后增加了 25.68%±40.42 (p=0.007)、29.39%±23.39 (p=0.0001) 和 37.63%±52.73 (p) =0.007),分别。
HBOT后衰老T辅助细胞的数量显着减少-37.30%±33.04(P<0.0001)。T 细胞毒性衰老细胞百分比在 HBOT 后显着降低 -10.96%±12.59 (p=0.0004)。
总之,该研究表明,HBOT 可能会诱导显着的衰老作用,包括显着增加端粒长度和老龄化人群中衰老细胞的清除。
介绍
衰老的特征在于生理完整性的逐渐丧失,导致功能受损以及疾病和死亡的易感性。这种生物退化被认为是癌症、心血管疾病、糖尿病和阿尔茨海默病等的主要风险因素。在细胞水平上,衰老过程有两个关键标志:端粒长度缩短和细胞衰老 [ 1 ]。
端粒是位于染色体末端的串联核苷酸重复序列,可维持基因组的稳定性。由于固有的无法完全复制滞后 DNA 链的末端部分,端粒在复制(有丝分裂)过程中会缩短 [ 2 ]。端粒长度(TL),4至15个碱基之间测量,逐渐缩短每年由〜20-40个碱基,并与不同的疾病,低物理性能和大脑[的皮质变薄相关联3 - 5 ]。当 TL 达到临界长度时,细胞无法复制并进入衰老或程序性细胞死亡 [ 6 ]。戈格林等人。证明具有较短 TL 的成年人死亡率增加 [ 7]]。缩短的 TL 可能是直接遗传特征,但一些环境因素也与缩短 TL 相关,包括压力、缺乏体力活动、体重指数过高、吸烟、慢性炎症、维生素缺乏和氧化应激 [ 2 , 8 , 9] ]。
细胞衰老是细胞周期的停滞,这可能由端粒缩短 [ 10 ] 以及其他与 TL 无关的衰老相关刺激引起,例如非端粒 DNA 损伤 [ 1 ]。衰老的主要目的是通过免疫系统触发它们的消除来防止受损细胞的繁殖。衰老细胞随着衰老而积累,反映了这些细胞生成的增加和/或清除率的降低,这反过来又会加剧损伤并促进衰老[ 1 ]。
越来越多的研究发现了几种可以降低端粒缩短率的药物 [ 11 , 12 ]。包括耐力训练、饮食和针对细胞代谢和氧化应激的补充剂在内的几种生活方式干预措施对 TL 3 的影响相对较小 (2-5%) , [ 2 , 8 , 9 ]。
高压氧疗法 (HBOT) 在高于一个绝对大气压 (ATA) 的环境压力下利用 100% 的氧气来增加溶解在身体组织中的氧气量。重复间歇性高氧暴露,使用某些 HBOT 协议,可以诱发生理效应,这通常发生在高氧环境中的缺氧期间,即所谓的高氧缺氧悖论 [ 13 – 16 ]。此外,最近证明 HBOT 可以通过涉及脑血流区域变化的机制诱导健康老年人的认知增强 [ 17]]。在细胞水平上,已证明 HBOT 可诱导缺氧诱导因子 (HIF)、血管内皮生长因子 (VEGF) 和沉默调节蛋白 (SIRT)、干细胞增殖、线粒体生物发生、血管生成和神经发生的表达 [ 18 ]。然而,迄今为止还没有研究检查过 HBOT 对 TL 和衰老细胞积累的影响。
本研究的目的是评估 HBOT 是否影响老年人的 TL 和衰老样 T 细胞群。
结果
35 个人被分配到 HBOT。五名患者未完成基线评估并被排除在外。完成基线评估的所有 30 名患者均完成了干预。由于血液样本质量低(细胞数量少或技术人员错误),4 名患者被排除在端粒分析之外,10 名患者被排除在衰老细胞分析之外(图 1)。表1中提供了排除患者后队列的基线特征和比较。三组之间没有显着差异(表1)。
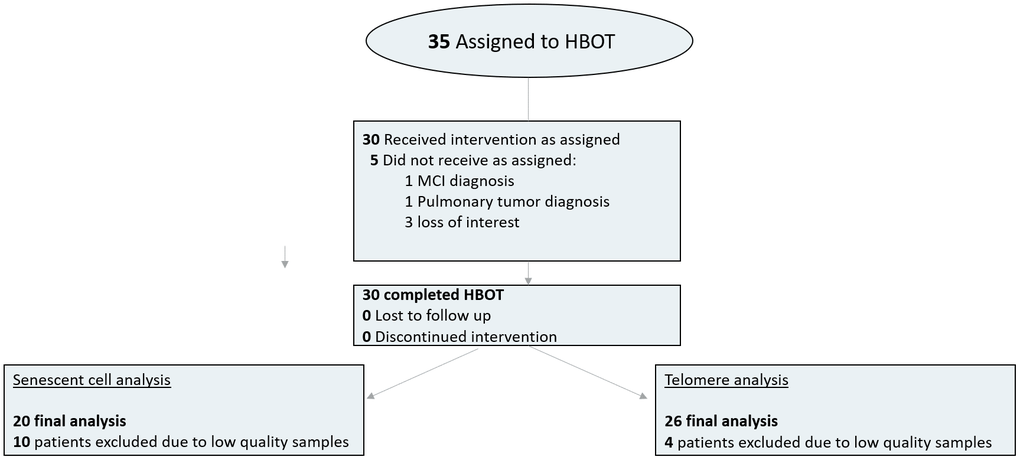
图 1. 患者流程图。
表 1. 基线特征。
|
|
|
热电偶
|
端粒分析
|
衰老分析
|
P值
|
|
N
|
|
30
|
25 (83.3%)
|
20 (66.6%)
|
|
|
年龄(岁)
|
|
68.41±13.2
|
67.56±14.35
|
66.70±16.00
|
0.917
|
|
体重指数
|
|
26.77±3.20
|
26.89±3.34
|
27.14±3.81
|
0.946
|
|
男性
|
|
16 (53.3%)
|
13 (52.0%)
|
10 (50.0%)
|
0.987
|
|
女性
|
|
14 (47.7%)
|
12 (48.0%)
|
10 (50.0%)
|
0.987
|
|
全血细胞计数
|
|
|
|
|
|
|
|
血红蛋白
|
6.33±1.25
|
6.57±1.15
|
6.58±1.29
|
0.707
|
|
|
白血细胞
|
14.02±1.40
|
13.92±1.35
|
13.97±1.49
|
0.969
|
|
|
%PBMC
|
39.96±6.75
|
39.25±6.64
|
38.59±6.63
|
0.774
|
|
|
血小板
|
239.87±1.39
|
244.08±43.0
|
254.05±41.4
|
0.559
|
|
慢性病
|
|
|
|
|
|
|
心房颤动
|
4 (13.3%)
|
4 (16.0%)
|
2 (10.0%)
|
0.841
|
|
|
甲状腺功能减退症
|
4 (13.3%)
|
4 (16.0%)
|
3 (15.8%)
|
0.956
|
|
|
阻塞性睡眠呼吸暂停
|
4 (13.3%)
|
4 (16.0%)
|
3 (15.0%)
|
0.961
|
|
|
哮喘
|
1 (3.3%)
|
1 (4.0%)
|
0
|
0.680
|
|
|
前列腺增生症
|
7 (23.3%)
|
5 (20.0%)
|
6 (30.0%)
|
0.733
|
|
|
GERD
|
3 (10%)
|
2 (8.0%)
|
2 (10.0%)
|
0.961
|
|
|
骨质疏松症
|
5 (16.7%)
|
5 (20.0%)
|
4 (20.0%)
|
0.936
|
|
|
风湿性关节炎
|
1 (3.3%)
|
0
|
1 (5.0%)
|
0.561
|
|
|
骨关节炎
|
7 (23.3%)
|
4 (16.0%)
|
5 (25.0%)
|
0.755
|
|
|
糖尿病
|
3 (10%)
|
3 (12.0%)
|
2 (10.0%)
|
0.966
|
|
|
高血压
|
7 (23.3%)
|
5 (20.0%)
|
5 (25.0%)
|
0.918
|
|
|
血脂异常
|
16 (53.3%)
|
14 (56.0%)
|
12 (60.0%)
|
0.897
|
|
|
缺血性心脏病
|
2 (6.7%)
|
1 (4.0%)
|
2 (10.0%)
|
0.725
|
|
|
吸烟史
|
10 (33.3%)
|
8 (32.0%)
|
7 (35.0%)
|
0.978
|
|
慢性药物
|
|
|
|
|
|
|
反聚合
|
8 (26.7%)
|
6 (24.0%)
|
5 (25.0%)
|
0.974
|
|
|
ACE抑制剂/ARB阻滞剂
|
6 (20%)
|
6 (24.0%)
|
6 (30.0%)
|
0.720
|
|
|
β受体阻滞剂
|
5 (16.7%)
|
5 (20.0%)
|
3 (15.0%)
|
0.901
|
|
|
钙阻滞剂
|
3 (10%)
|
3 (12.0%)
|
2 (10.0%)
|
0.966
|
|
|
阿尔法受体阻滞剂
|
7 (23.3%)
|
5 (20.0%)
|
6 (30.0%)
|
0.733
|
|
|
利尿剂
|
2 (6.7%)
|
1 (4.0%)
|
1 (5.0%)
|
0.906
|
|
|
他汀类药物
|
10 (33.3%)
|
9 (36.0%)
|
7 (35.0%)
|
0.978
|
|
|
口服降糖药
|
1 (3.3%)
|
1 (4.0%)
|
1 (5.0%)
|
0.958
|
|
|
双膦酸盐
|
1 (3.3%)
|
1 (4.0%)
|
1 (5.0%)
|
0.958
|
|
|
质子泵抑制剂
|
3 (10%)
|
3 (12.0%)
|
3 (15.0%)
|
0.726
|
|
|
激素
|
3 (10%)
|
3 (12.0%)
|
2 (10.0%)
|
0.966
|
|
|
苯二氮卓类
|
3 (10%)
|
2 (8.0%)
|
1 (5.0%)
|
0.816
|
|
|
SSRI
|
5 (16.7%)
|
5 (20.0%)
|
3 (15.0%)
|
0.990
|
端粒长度
与基线相比,第 30次和 HBOT 后T 辅助端粒长度显着增加21.70±40.05 (p=0.042)、23.69%±39.54 (p=0.012) 和 29.30±38.51 (p=0.00) ),分别(图2)。然而,重复测量分析显示出不显着的趋势(F=4.663,p=0.06,表 2和图 2)。
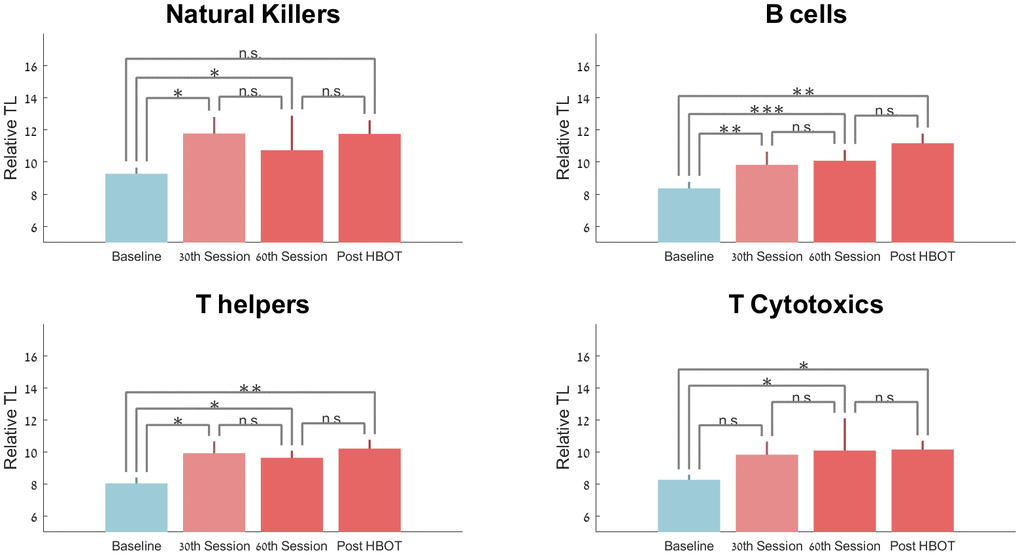
图 2. 端粒长度随 HBOT 的变化。平均值+SEM *p<0.05,**p<0.01,***p<0.001。
表 2. HBOT 后端粒长度和衰老细胞的变化。
|
|
|
绝对的变化
|
相对变化 (%)
|
重复测量 F (p)
|
|
PBMC
|
基线
|
第30届
|
|
第60届会议
|
后 HBOT
|
第30届
|
第60届会议
|
后HBOT
|
|
PBMC ((N=25)
|
2.55±0.53
|
|
|
|
-0.15±0.40
|
|
|
-4.91±16.70
|
1.987 (吨) 0.09
|
|
PBMC (N=20)
|
2.50±0.53
|
|
|
|
-0.13±0.31
|
|
|
-4.21±11.99
|
1.810 (吨) 0.07
|
|
相对端粒长度 (N=25)
|
|
自然杀手
|
9.27±1.91
|
11.77±5.14 (0.045)
|
|
10.73±2.73 (0.013)
|
11.75±4.22 (0.06)
|
25.02±51.42
|
20.56±33.35
|
22.16±44.81
|
0.812 (0.391)
|
|
B细胞
|
8.36±2.02
|
10.22±3.04 (0.007)
|
|
11.23±3.58 (0.0001)
|
11.17±2.98 (0.007)
|
25.68±40.42
|
29.39±23.39
|
37.63±52.73
|
7.390 (0.017)
|
|
帮手
|
8.04±1.82
|
9.92±3.68 (0.042)
|
|
9.63±2.17 (0.012)
|
10.20±2.77 (0.005)
|
21.70±40.05
|
23.69±39.54
|
29.30±38.51
|
4.663 (0.063)
|
|
细胞毒
|
8.26±1.54
|
9.83±4.08 (0.11)
|
|
10.08±3.33 (0.019)
|
10.15±2.74 (0.023)
|
18.29±45.62
|
24.13±40.88
|
19.59±33.98
|
1.159 (0.310)
|
|
衰老细胞(T 细胞的百分比)(N=20)
|
|
帮手
|
10.29±5.42
|
7.84±7.09 (0.09)
|
|
8.51±7.45 (0.20)
|
6.22 ± 4.88 (< 0.0001 )
|
-19.66±80.03
|
-11.67±94.30
|
-37.30±33.04
|
8.548 (0.01)
|
|
细胞毒
|
52.19±21.07
|
45.53 ± 19.91 (< 0.0001 )
|
|
45.45±18.81 (0.002)
|
46.59±21.91 (0.0004)
|
-12.21±8.74
|
-9.81±9.50
|
-10.96±12.59
|
6.916 (0.018)
|
|
() 中显示的 P 值与基线相比。
|
|
粗体的 P 值 <0.05。
|
与基线相比,B 细胞的端粒长度在第 30次、第60次和 HBOT 后显着增加25.68%±40.42(p=0.007)、29.39%±23.39(p=0.0001)和 37.63%±52.73( p=0.007),分别(图2)。重复测量分析显示了显着的组内效应(F=0.390,p=0.017,表 2和图 2)。
与基线相比,自然杀伤细胞端粒长度在第 30次会议 (p=0.045) 和第 60次会议时显着增加了 20.56% ±33.35 (p=0.013)。HBOT 后,端粒长度在 HBOT 后增加了 22.16%±44.81(p=0.06,表 2和图 2)。重复测量分析表明,在第 30次会议后没有额外的显着影响(F=0.812,p=0.391)。
与基线相比,细胞毒性 T 细胞在第 30次会话时无显着增加18.29%±45.62 (p=0.11),随后在第 60次会话时显着增加 24.13%±40.88 (p=0.0019) HBOT 后为 19.59%±33.98(p=0.023)。重复测量分析表明,在第 30次会议后没有额外的显着影响(F=1.159,p=0.310,表 2和图 2)。
衰老细胞
第 30次和第60次的衰老 T-helper 数量分别下降-19.66%±80.03 (p=0.09) 和 -11.67%±94.30 (p=0.20)。然而,HBOT后衰老T辅助细胞的数量显着下降-37.30%±33.04(P<0.0001,图3)。重复测量分析表明,即使在第 30次会议之后,仍具有显着的持续效应,具有组内效应(F=8.547,p=0.01,表 2和图 3)。
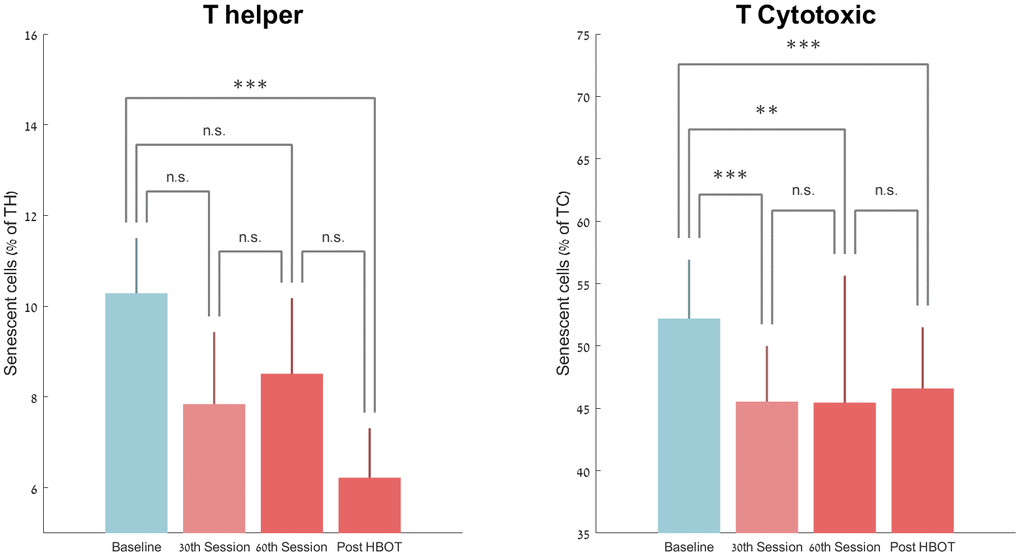
图 3. HBOT 引起的衰老细胞变化。平均值+SEM *p<0.05,**p<0.01,***p<0.001。
T 细胞毒性衰老细胞百分比在第 30次HBOT 会话时显着下降 -12.21%±8.74 (P<0.0001),在第60次HBOT 会话时-9.81%±9.50 (0.002) 和 -10.96%±12.59 (p=0.000) )后 HBOT(表 2和图 3)。重复测量分析显示即使在第 30次会议之后仍具有显着的持续效应,具有组内效应(F=6.916,p=0.018,表 2)。
HIF-1α
HIF-1alpha 水平在第 60次会议时从 10.54±3.39 增加到 19.71±3.39 (p=0.006),其中 HBOT 后 2 周水平 16.81±7.65 与基线没有显着差异 (p=0.16)。
讨论
在这项研究中,首次在人类中发现重复的每日 HBOT 会话可以使老龄化人群的 PBMC 端粒长度增加 20% 以上,其中 B 细胞的变化最为显着。此外,HBOT 将衰老细胞的数量减少了 10-37%,其中 T 辅助衰老细胞受到的影响最大。
已经观察到端粒长度和生活方式改变之间存在大量关联。这导致了几项干预性研究,其中包括饮食、补充剂(如 omega-3 和核桃等)、体育锻炼、压力管理和社会支持。一项对认知健康的老年人使用富含核桃的饮食进行的为期两年的试验显示,与对照饮食相比,保留端粒长度的趋势不显着 [ 19 ]。在另一项评估老年人 12 周低频爆发式抗阻训练效果的研究中,干预组的端粒长度得到更好的保留,而没有显着增加 [ 20]]。最近的一项研究发现,六个月的有氧耐力训练或高强度间歇训练可使端粒长度增加 5% [ 21 ]。额外的减肥、瑜伽和压力管理技术未能显示出显着的端粒长度变化 [ 22 – 25 ]。然而,大多数这些研究已显示抗氧化活性和端粒酶活性[之间显著相关性22 - 25 ]。
虽然许多遗传和环境因素与端粒缩短有关,但最常见的机制是氧化应激。氧化应激可能由活性氧 (ROS) 的产生与细胞清除剂之间的不平衡引起。端粒对氧化性 DNA 损伤高度敏感,可导致端粒缩短和功能障碍 [ 26 ]。在过去的几十年里,氧和/或氧化应激与端粒长度之间的关联一直存在争议。人类细胞培养研究一致表明,轻度氧化应激会加速端粒缩短,而抗氧化剂和自由基清除剂会降低端粒缩短率并延长细胞增殖寿命 [ 27]]。多项关于病理状况(如糖尿病、炎症性疾病、帕金森病)的临床研究表明,氧化应激标志物、活性氧清除剂水平和端粒长度之间存在相关性 [ 28 ]。然而,健康个体并没有表现出类似的结果 [ 29 ]。
以前曾有人建议将细胞培养物暴露于高压环境中会诱导显着的氧化应激和细胞过早衰老 [ 30 ]。然而,这是基于在高压培养箱中生长的分离细胞,而不是本研究中人类复杂的生物系统。与目前的研究类似,之前对暴露于强高压氧的潜水员进行的一项为期一年的前瞻性观察研究表明,白细胞的端粒显着延长 [ 31 ]。正如当前研究中所使用的,HBOT 协议利用了重复间歇性高氧暴露引起的影响,即所谓的高氧缺氧悖论 [ 13 , 18]]。这些间歇性高氧暴露诱导了一种适应性反应,其中包括抗氧化剂基因 [ 32 ] 的上调增加和抗氧化剂/清除剂的产生,这些抗氧化剂/清除剂适应增加的 ROS 生成,导致 ROS/清除剂比率逐渐变得与正常氧气环境下的比率相似。然而,由于清除剂消除半衰期 (T 1/2 ) 显着长于ROS的 T 1/2,在恢复到常氧后,重复高氧暴露后,清除剂水平显着升高,抗氧化活性增加 [ 13] , 18]。因此,类似于体育锻炼和热量限制,每天重复的 HBOT 方案可以诱发兴奋现象。单次暴露会急剧增加 ROS 的产生,触发抗氧化反应,而重复暴露后,反应变得保护性 [ 13 , 18 ]。
此外,间歇性高氧暴露会诱发许多在缺氧期间发生的生理反应 [ 13 ]。HBOT 诱导称为缺氧诱导因子 (HIF) 的转录因子的释放,并增加其稳定性和活性 [ 14 ]。反过来,HIF 诱导细胞级联反应,包括血管内皮生长因子和血管生成诱导、线粒体生物发生、干细胞动员和 SIRT1 活性增加 [ 18 ]。我们的研究证实,HIF 表达增加是由重复的 HBOT 暴露诱导的,在非单一环境下,HIF 水平逐渐降低,趋向于正常化。
目前,许多通过基因或药理学(senolytic 药物)去除衰老细胞的干预措施已在动物模型中开发出来,正在等待对人体的安全性和有效性评估 [ 33 ]。目前的研究提出了一种非药物方法,临床上可用且安全性良好,可减少衰老细胞数量。我们的协议包括 2 ATA 的 60 次 100% 氧气会话,包括每次会话期间的 3 次空气中断,以利用高氧缺氧悖论并最大限度地减少氧中毒的风险。有趣的是,TL和衰老细胞减少峰值在30个会议。然而,与施加的压力、时间和 HBOT 暴露次数相关的剂量反应曲线及其与 HIF 表达及其相关再生效应的关系仍未完全了解,需要进一步研究以找到最佳的 HBOT 方案。
高压氧疗法是一种成熟的治疗方式,可用于治疗不愈合伤口、放射损伤以及不同的缺氧或缺血事件(如一氧化碳中毒、感染等)。近年来,从临床前一个越来越多的证据以及临床试验表明高压氧用于治疗神经适应症,包括特发性突发性感觉神经性听力损失[功效34 ],卒中后和后创伤性脑损伤[ 35 - 41 ],中枢致敏综合征例如纤维肌痛综合征 [ 42 , 43 ] 和与年龄相关的认知能力下降 [ 17 ] 和阿尔茨海默病的动物模型 [ 44]]。目前的研究首次旨在评估在没有任何功能限制性疾病的情况下对衰老人类细胞水平的生理影响。
研究限制
目前的研究有几个局限性和优势需要考虑。首先,必须考虑有限的样本量。二是缺乏对照组。然而,该研究表明在 TL 和衰老细胞清除方面取得了令人印象深刻的结果,这在其他干预措施中没有观察到。此外,我们队列的基线端粒长度值与老龄化人口的预期值相匹配 [ 45 – 47]。第三,效果的持续时间还有待长期随访确定。第四,由于选择了用于血液保存和评估的方法,未评估端粒酶活性。然而,应该强调几个优势。在这项研究中,CD28 被用作衰老细胞的生物标志物,而 CD57 不能用作 T 细胞衰老的确认标志物。生物标志物是针对特定的白细胞群进行评估的,而不是使用整个 PBMC 作为一组。测量了孤立的 HBOT 效应,并监测参与者没有进行任何生活方式改变(例如营养和运动)、药物治疗或任何其他可能作为混杂因素的干预。
总之,该研究表明,HBOT 可以诱导显着的衰老作用,包括显着增加端粒长度和清除衰老细胞中的衰老细胞。
材料和方法
科目
招募了 35 名没有病理性认知能力下降的成年人,年龄在 64 岁及以上,独立生活,功能和认知状态良好。该研究于 2016 年至 2020 年在以色列 Shamir (Assaf-Harofeh) 医疗中心进行。纳入的患者在纳入之前的最后一年没有心脏或脑血管缺血史。排除标准包括:过去三个月因任何原因接受过 HBOT 治疗,过去一年有任何恶性肿瘤病史,任何病理性认知能力下降,严重慢性肾功能衰竭(GFR <30),未控制的糖尿病(HbA1C>8,禁食)葡萄糖>200)、免疫抑制剂、MRI禁忌症(包括BMI>35)、主动吸烟或肺部疾病。
学习规划
该研究方案得到了以色列沙米尔医疗中心机构审查委员会的批准。该研究是作为一项前瞻性临床试验进行的。在签署知情同意书并进行基线评估后,受试者被分配到 HBOT。测量点在基线、治疗方案的半点(第30次疗程)、最后一次 HBOT疗程的当天和 HBOT 后 1-2 周进行评估。
该研究队列仅包括接受 HBOT 治疗的患者,这是在以色列 Shamir 医疗中心研究的更大的正常老龄化人群队列的一部分 (NCT02790541 [ 17 ])。
干预
HBOT 方案在 Multiplace Starmed-2700 室(HAUX,德国)中进行。该协议包括 60 个每日会话,三个月内每周 5 个会话。每次训练包括在 2ATA 通过面罩呼吸 100% 氧气 90 分钟,每 20 分钟呼吸 5 分钟。压缩/减压速率为1米/分钟。在试验期间,不允许改变生活方式和饮食,也不允许调整药物。
血液样本
使用标准技术将全血样本收集到 EDTA 管中,在基线、HBOT 方案的半点(第30次会话)、最后一次 HBOT 会话的当天(第60次会话)和HBOT 会话后的1-2 周上次 HBOT 会议。
外周血单个核细胞 (PBMC) 分离
使用磷酸盐缓冲盐水 (PBS) 稀释全血。使用装有 Lymphoprep 的 Leucosep 管进行密度梯度分离。然后将管在 25°C 下以 1000 x g离心10 分钟。离心后,立即通过移液管收集细胞层(血沉棕黄层)并转移到 50 mL 锥形离心管中,用足量的 1X PBS 重悬至 50 mL,并在 25°C 度下以 300× g离心10 分钟。去除上清液后,对每个样品进行标记。
端粒长度
根据 Dako PNA/FITC 试剂盒协议(代码 K5327)标记端粒。在由 PBMC(样品细胞)和 TCL 1301 细胞系(对照细胞)的混合物组成的单细胞悬液上,DNA 在微量离心管中在 82°C 下变性 10 分钟,在没有探针的杂交溶液中或在含有荧光素偶联的 PNA 端粒探针的杂交溶液中。杂交在室温 (RT) 下在黑暗中进行过夜。杂交后用 40°C 的洗涤液进行两次 10 分钟的杂交后洗涤。然后在适当的缓冲液中用 CD4+、CD8+、CD3+、CD19+ 和 CD56+ 偶联抗体标记样品,以进行进一步的流式细胞术分析 [ 48 , 49]。每个样品一式两份运行。流式细胞术分析后,计算 CD3+/CD4+(T 辅助细胞)、CD3+/CD8+(T-细胞毒性)、CD3+/CD56+(自然杀伤细胞)和 CD19+(B 细胞)的相对端粒长度 (RTL)。RTL 值计算为每个样品的端粒信号与对照细胞(TCL 1301 细胞系)的比值,并校正 G0/1 细胞的 DNA 指数。使用碘化丙啶染色分别分析样品细胞和对照细胞的 DNA 倍性,以标准化每个细胞的端粒末端数量,从而标准化每个染色体的端粒长度。有关FACS 分析示例,请参见图 4。
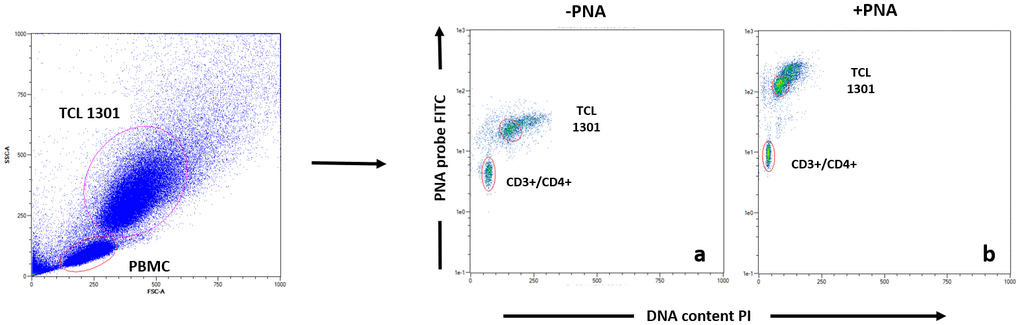
图 4. T helper 亚群的 Flow Fish 数据分析示例。在数据采集之前,每个血样都用 PNA 探针 ( b ) 或不使用 ( a ) 染色,然后进行抗体染色(CD3、CD4、CD8、CD16、CD19)。
免疫表型
CD3+CD4+CD28-null T 细胞(衰老 T 辅助细胞)和 CD3+CD8+CD28-null T 细胞(衰老 T 细胞毒物)的百分比通过流式细胞术分析确定。PBMC 用 VioBlue 偶联抗 CD3、Viogreen 偶联抗 CD8、PE-VIO 770A 偶联抗 CD4 和 APC-VIO 770A 抗 CD28 抗体(Miltenyi Biotec)染色。用 MACSQuant 流式细胞仪 (Miltenyi Biotec) 分析细胞。然后计算 CD4+ 或 CD8+ T 细胞群中 CD28null T 细胞的百分比。
缺氧诱导因子(HIF-1alpha)
在固定和透化(Life Technologies)后,用 APC 偶联的抗 HIF1a 抗体或相应的同种型对照(研发系统)进行细胞内 HIF1a 染色。用 MACSQuant 流式细胞仪 (Miltenyi Biotec) 分析细胞,并确定表达 HIF1a 的 PBMC 的百分比。
统计分析
除非另有说明,连续数据表示为平均值±标准差。使用 Kolmogorov-Smirnov 检验测试所有变量的正态分布。进行单向方差分析以比较基线时三组之间和三组内的变量。
分类数据以数字和百分比表示,并通过卡方检验进行比较。使用卡方/费舍尔精确检验进行单变量分析以确定显着变量(P<0.05)。
为了评估 HBOT 的效果,使用重复测量方差分析模型来测试主要的受试者内效应。对均值进行事后检验以使用带有 Bonferroni 校正的 t 检验来检验时间差异。
作者贡献
所有作者都为本手稿的准备做出了重大贡献。HY、HA、ES 负责协议设计。HA、ZY、BY、ES、DKM 负责患者招募。YH、AHR、SM、YY、SM、ZR、ESW、HA、DKM、SG、BGR、DG、HY、AHR、FG、LE、PN、DK、FM、ZY、BY负责数据采集。哈,哈。ES负责数据分析。所有作者都解释了数据。HY、HA、CM 和 ES 撰写了手稿。所有作者都修改并完成了手稿。
致谢
我们要感谢 Mechael Kanovsky 博士对这份手稿的编辑。
利益冲突
AH, BY, ZY 为 AVIV Scientific LTD 工作。ES 是 AVIV Scientific LTD 的股东。
资金
该研究由 Sami Sagol 先生建立的 Sagol 神经科学网络的研究资助资助。
参考
-
1. López-Otín C, Blasco MA, Partridge L, Serrano M, Kroemer G. The hallmarks of aging. Cell. 2013; 153:1194–217.a https://doi.org/10.1016/j.cell.2013.05.039 [PubMed]
2. Tsoukalas D, Fragkiadaki P, Docea AO, Alegakis AK, Sarandi E, Vakonaki E, Salataj E, Kouvidi E, Nikitovic D, Kovatsi L, Spandidos DA, Tsatsakis A, Calina D. Association of nutraceutical supplements with longer telomere length. Int J Mol Med. 2019; 44:218–26. https://doi.org/10.3892/ijmm.2019.4191 [PubMed]
3. Starkweather AR, Alhaeeri AA, Montpetit A, Brumelle J, Filler K, Montpetit M, Mohanraj L, Lyon DE, Jackson-Cook CK. An integrative review of factors associated with telomere length and implications for biobehavioral research. Nurs Res. 2014; 63:36–50. https://doi.org/10.1097/NNR.0000000000000009 [PubMed]
4. Puhlmann LM, Valk SL, Engert V, Bernhardt BC, Lin J, Epel ES, Vrticka P, Singer T. Association of short-term change in leukocyte telomere length with cortical thickness and outcomes of mental training among healthy adults: a randomized clinical trial. JAMA Netw Open. 2019; 2:e199687. https://doi.org/10.1001/jamanetworkopen.2019.9687 [PubMed]
5. Åström MJ, von Bonsdorff MB, Perälä MM, Salonen MK, Rantanen T, Kajantie E, Simonen M, Pohjolainen P, Haapanen MJ, Guzzardi MA, Iozzo P, Kautiainen H, Eriksson JG. Telomere length and physical performance among older people-the helsinki birth cohort study. Mech Ageing Dev. 2019; 183:111145. https://doi.org/10.1016/j.mad.2019.111145 [PubMed]
6. Xie Z, Jay KA, Smith DL, Zhang Y, Liu Z, Zheng J, Tian R, Li H, Blackburn EH. Early telomerase inactivation accelerates aging independently of telomere length. Cell. 2015; 160:928–39. https://doi.org/10.1016/j.cell.2015.02.002 [PubMed]
7. Goglin SE, Farzaneh-Far R, Epel ES, Lin J, Blackburn EH, Whooley MA. Change in leukocyte telomere length predicts mortality in patients with stable coronary heart disease from the heart and soul study. PLoS One. 2016; 11:e0160748. https://doi.org/10.1371/journal.pone.0160748 [PubMed]
8. Armanios M. Telomeres and age-related disease: how telomere biology informs clinical paradigms. J Clin Invest. 2013; 123:996–1002. https://doi.org/10.1172/JCI66370 [PubMed]
9. Richards JB, Valdes AM, Gardner JP, Paximadas D, Kimura M, Nessa A, Lu X, Surdulescu GL, Swaminathan R, Spector TD, Aviv A. Higher serum vitamin D concentrations are associated with longer leukocyte telomere length in women. Am J Clin Nutr. 2007; 86:1420–25. https://doi.org/10.1093/ajcn/86.5.1420 [PubMed]
10. Bodnar AG, Ouellette M, Frolkis M, Holt SE, Chiu CP, Morin GB, Harley CB, Shay JW, Lichtsteiner S, Wright WE. Extension of life-span by introduction of telomerase into normal human cells. Science. 1998; 279:349–52. https://doi.org/10.1126/science.279.5349.349 [PubMed]
11. Townsley DM, Dumitriu B, Liu D, Biancotto A, Weinstein B, Chen C, Hardy N, Mihalek AD, Lingala S, Kim YJ, Yao J, Jones E, Gochuico BR, et al. Danazol treatment for telomere diseases. N Engl J Med. 2016; 374:1922–31. https://doi.org/10.1056/NEJMoa1515319 [PubMed]
12. Coutts F, Palmos AB, Duarte RR, de Jong S, Lewis CM, Dima D, Powell TR. The polygenic nature of telomere length and the anti-ageing properties of lithium. Neuropsychopharmacology. 2019; 44:757–65. https://doi.org/10.1038/s41386-018-0289-0 [PubMed]
13. Cimino F, Balestra C, Germonpré P, De Bels D, Tillmans F, Saija A, Speciale A, Virgili F. Pulsed high oxygen induces a hypoxic-like response in human umbilical endothelial cells and in humans. J Appl Physiol (1985). 2012; 113:1684–89. https://doi.org/10.1152/japplphysiol.00922.2012 [PubMed]
14. Sunkari VG, Lind F, Botusan IR, Kashif A, Liu ZJ, Ylä-Herttuala S, Brismar K, Velazquez O, Catrina SB. Hyperbaric oxygen therapy activates hypoxia-inducible factor 1 (HIF-1), which contributes to improved wound healing in diabetic mice. Wound Repair Regen. 2015; 23:98–103. https://doi.org/10.1111/wrr.12253 [PubMed]
15. Milovanova TN, Bhopale VM, Sorokina EM, Moore JS, Hunt TK, Hauer-Jensen M, Velazquez OC, Thom SR. Hyperbaric oxygen stimulates vasculogenic stem cell growth and differentiation in vivo. J Appl Physiol (1985). 2009; 106:711–28. https://doi.org/10.1152/japplphysiol.91054.2008 [PubMed]
16. Yang Y, Wei H, Zhou X, Zhang F, Wang C. Hyperbaric oxygen promotes neural stem cell proliferation by activating vascular endothelial growth factor/extracellular signal-regulated kinase signaling after traumatic brain injury. Neuroreport. 2017; 28:1232–38. https://doi.org/10.1097/WNR.0000000000000901 [PubMed]
17. Hadanny A, Daniel-Kotovsky M, Suzin G, Boussi-Gross R, Catalogna M, Dagan K, Hachmo Y, Abu Hamed R, Sasson E, Fishlev G, Lang E, Polak N, Doenyas K, et al. Cognitive enhancement of healthy older adults using hyperbaric oxygen: a randomized controlled trial. Aging (Albany NY). 2020; 12:13740–61. https://doi.org/10.18632/aging.103571 [PubMed]
18. Hadanny A, Efrati S. The hyperoxic-hypoxic paradox. Biomolecules. 2020; 10:958. https://doi.org/10.3390/biom10060958 [PubMed]
19. Freitas-Simoes TM, Cofán M, Blasco MA, Soberón N, Foronda M, Serra-Mir M, Roth I, Valls-Pedret C, Doménech M, Ponferrada-Ariza E, Calvo C, Rajaram S, Sabaté J, et al. Walnut consumption for two years and leukocyte telomere attrition in mediterranean elders: results of a randomized controlled trial. Nutrients. 2018; 10:1907. https://doi.org/10.3390/nu10121907 [PubMed]
20. Dimauro I, Scalabrin M, Fantini C, Grazioli E, Beltran Valls MR, Mercatelli N, Parisi A, Sabatini S, Di Luigi L, Caporossi D. Resistance training and redox homeostasis: correlation with age-associated genomic changes. Redox Biol. 2016; 10:34–44. https://doi.org/10.1016/j.redox.2016.09.008 [PubMed]
21. Werner CM, Hecksteden A, Morsch A, Zundler J, Wegmann M, Kratzsch J, Thiery J, Hohl M, Bittenbring JT, Neumann F, Böhm M, Meyer T, Laufs U. Differential effects of endurance, interval, and resistance training on telomerase activity and telomere length in a randomized, controlled study. Eur Heart J. 2019; 40:34–46. https://doi.org/10.1093/eurheartj/ehy585 [PubMed]
22. Sanft T, Usiskin I, Harrigan M, Cartmel B, Lu L, Li FY, Zhou Y, Chagpar A, Ferrucci LM, Pusztai L, Irwin ML. Randomized controlled trial of weight loss versus usual care on telomere length in women with breast cancer: the lifestyle, exercise, and nutrition (LEAN) study. Breast Cancer Res Treat. 2018; 172:105–12. https://doi.org/10.1007/s10549-018-4895-7 [PubMed]
23. Mason C, Risques RA, Xiao L, Duggan CR, Imayama I, Campbell KL, Kong A, Foster-Schubert KE, Wang CY, Alfano CM, Blackburn GL, Rabinovitch PS, McTiernan A. Independent and combined effects of dietary weight loss and exercise on leukocyte telomere length in postmenopausal women. Obesity (Silver Spring). 2013; 21:E549–54. https://doi.org/10.1002/oby.20509 [PubMed]
24. Krishna BH, Keerthi GS, Kumar CK, Reddy NM. Association of leukocyte telomere length with oxidative stress in yoga practitioners. J Clin Diagn Res. 2015; 9:CC01–03. https://doi.org/10.7860/JCDR/2015/13076.5729 [PubMed]
25. Tehfe M, Dowden S, Kennecke H, El-Maraghi R, Lesperance B, Couture F, Letourneau R, Liu H, Romano A. Erratum to: nab-paclitaxel plus gemcitabine versus gemcitabine in patients with metastatic pancreatic adenocarcinoma: canadian subgroup analysis of the phase 3 MPACT trial. Adv Ther. 2017; 34:277–79. https://doi.org/10.1007/s12325-016-0442-2 [PubMed]
26. Barnes RP, Fouquerel E, Opresko PL. The impact of oxidative DNA damage and stress on telomere homeostasis. Mech Ageing Dev. 2019; 177:37–45. https://doi.org/10.1016/j.mad.2018.03.013 [PubMed]
27. von Zglinicki T. Oxidative stress shortens telomeres. Trends Biochem Sci. 2002; 27:339–44. https://doi.org/10.1016/s0968-0004(02)02110-2 [PubMed]
28. Sampson MJ, Winterbone MS, Hughes JC, Dozio N, Hughes DA. Monocyte telomere shortening and oxidative DNA damage in type 2 diabetes. Diabetes Care. 2006; 29:283–89. https://doi.org/10.2337/diacare.29.02.06.dc05-1715 [PubMed]
29. Reichert S, Stier A. Does oxidative stress shorten telomeres in vivo? a review. Biol Lett. 2017; 13:20170463. https://doi.org/10.1098/rsbl.2017.0463 [PubMed]
30. Oh S, Lee E, Lee J, Lim Y, Kim J, Woo S. Comparison of the effects of 40% oxygen and two atmospheric absolute air pressure conditions on stress-induced premature senescence of normal human diploid fibroblasts. Cell Stress Chaperones. 2008; 13:447–58. https://doi.org/10.1007/s12192-008-0041-5 [PubMed]
31. Shlush LI, Skorecki KL, Itzkovitz S, Yehezkel S, Segev Y, Shachar H, Berkovitz R, Adir Y, Vulto I, Lansdorp PM, Selig S. Telomere elongation followed by telomere length reduction, in leukocytes from divers exposed to intense oxidative stress—implications for tissue and organismal aging. Mech Ageing Dev. 2011; 132:123–30. https://doi.org/10.1016/j.mad.2011.01.005 [PubMed]
32. Godman CA, Joshi R, Giardina C, Perdrizet G, Hightower LE. Hyperbaric oxygen treatment induces antioxidant gene expression. Ann N Y Acad Sci. 2010; 1197:178–83. https://doi.org/10.1111/j.1749-6632.2009.05393.x [PubMed]
33. Pignolo RJ, Passos JF, Khosla S, Tchkonia T, Kirkland JL. Reducing senescent cell burden in aging and disease. Trends Mol Med. 2020; 26:630–38. https://doi.org/10.1016/j.molmed.2020.03.005 [PubMed]
34. LE W. Hyperbaric Oxygen Therapy Indications. UHMS. 2008; 12th edition:215–218.
35. Boussi-Gross R, Golan H, Fishlev G, Bechor Y, Volkov O, Bergan J, Friedman M, Hoofien D, Shlamkovitch N, Ben-Jacob E, Efrati S. Hyperbaric oxygen therapy can improve post concussion syndrome years after mild traumatic brain injury - randomized prospective trial. PLoS One. 2013; 8:e79995. https://doi.org/10.1371/journal.pone.0079995 [PubMed]
36. Efrati S, Fishlev G, Bechor Y, Volkov O, Bergan J, Kliakhandler K, Kamiager I, Gal N, Friedman M, Ben-Jacob E, Golan H. Hyperbaric oxygen induces late neuroplasticity in post stroke patients—randomized, prospective trial. PLoS One. 2013; 8:e53716. https://doi.org/10.1371/journal.pone.0053716 [PubMed]
37. Mukherjee A, Raison M, Sahni T, Arya A, Lambert J, Marois P, James PB, Parent A, Ballaz L. Intensive rehabilitation combined with HBO2 therapy in children with cerebral palsy: a controlled longitudinal study. Undersea Hyperb Med. 2014; 41:77–85. [PubMed]
38. Hadanny A, Golan H, Fishlev G, Bechor Y, Volkov O, Suzin G, Ben-Jacob E, Efrati S. Hyperbaric oxygen can induce neuroplasticity and improve cognitive functions of patients suffering from anoxic brain damage. Restor Neurol Neurosci. 2015; 33:471–86. https://doi.org/10.3233/RNN-150517 [PubMed]
39. Tal S, Hadanny A, Berkovitz N, Sasson E, Ben-Jacob E, Efrati S. Hyperbaric oxygen may induce angiogenesis in patients suffering from prolonged post-concussion syndrome due to traumatic brain injury. Restor Neurol Neurosci. 2015; 33:943–51. https://doi.org/10.3233/RNN-150585 [PubMed]
40. Hadanny A, Rittblat M, Bitterman M, May-Raz I, Suzin G, Boussi-Gross R, Zemel Y, Bechor Y, Catalogna M, Efrati S. Hyperbaric oxygen therapy improves neurocognitive functions of post-stroke patients - a retrospective analysis. Restor Neurol Neurosci. 2020; 38:93–107. https://doi.org/10.3233/RNN-190959 [PubMed]
41. Tal S, Hadanny A, Sasson E, Suzin G, Efrati S. Hyperbaric oxygen therapy can induce angiogenesis and regeneration of nerve fibers in traumatic brain injury patients. Front Hum Neurosci. 2017; 11:508. https://doi.org/10.3389/fnhum.2017.00508 [PubMed]
42. Efrati S, Golan H, Bechor Y, Faran Y, Daphna-Tekoah S, Sekler G, Fishlev G, Ablin JN, Bergan J, Volkov O, Friedman M, Ben-Jacob E, Buskila D. Hyperbaric oxygen therapy can diminish fibromyalgia syndrome—prospective clinical trial. PLoS One. 2015; 10:e0127012. https://doi.org/10.1371/journal.pone.0127012 [PubMed]
43. Hadanny A, Bechor Y, Catalogna M, Daphna-Tekoah S, Sigal T, Cohenpour M, Lev-Wiesel R, Efrati S. Hyperbaric oxygen therapy can induce neuroplasticity and significant clinical improvement in patients suffering from fibromyalgia with a history of childhood sexual abuse-randomized controlled trial. Front Psychol. 2018; 9:2495. https://doi.org/10.3389/fpsyg.2018.02495 [PubMed]
44. Shapira R, Efrati S, Ashery U. Hyperbaric oxygen therapy as a new treatment approach for Alzheimer’s disease. Neural Regen Res. 2018; 13:817–18. https://doi.org/10.4103/1673-5374.232475 [PubMed]
45. Steenstrup T, Kark JD, Verhulst S, Thinggaard M, Hjelmborg JV, Dalgård C, Kyvik KO, Christiansen L, Mangino M, Spector TD, Petersen I, Kimura M, Benetos A, et al. Telomeres and the natural lifespan limit in humans. Aging (Albany NY). 2017; 9:1130–42. https://doi.org/10.18632/aging.101216 [PubMed]
46. Shammas MA. Telomeres, lifestyle, cancer, and aging. Curr Opin Clin Nutr Metab Care. 2011; 14:28–34. https://doi.org/10.1097/MCO.0b013e32834121b1 [PubMed]
47. Teubel I, Elchinova E, Roura S, Fernández MA, Gálvez-Montón C, Moliner P, de Antonio M, Lupón J, Bayés-Genís A. Telomere attrition in heart failure: a flow-FISH longitudinal analysis of circulating monocytes. J Transl Med. 2018; 16:35. https://doi.org/10.1186/s12967-018-1412-z [PubMed]
48. Baerlocher GM, Lansdorp PM. Telomere length measurements in leukocyte subsets by automated multicolor flow-FISH. Cytometry A. 2003; 55:1–6. https://doi.org/10.1002/cyto.a.10064 [PubMed]
49. Baerlocher GM, Lansdorp PM. Telomere length measurements using fluorescence in situ hybridization and flow cytometry. Methods Cell Biol. 2004; 75:719–50. https://doi.org/10.1016/s0091-679x(04)75031-1 [PubMed]